CaTCalc ソフトウェアを用いて断熱燃焼温度(断熱火炎温度)等を計算できますが、
その前に
手計算に用いる、標準エンタルピー値を求めてみよう。
教科書や演習問題には通常、1気圧、25℃(298.15ケルビン)における
ガス種・化合物の標準エンタルピー値(J/mol)が載っています。
この値をソフトウェアから求めてみよう。
操作は簡単である。
関係する元素を指定し、ガス種なら IdealGas.adb ファイルを選択する。
化合物(液体)なら PureLiq.adb を、
化合物(固体)なら PureSol.adb ファイルを選択する。
メイン画面にて、Gas相、ガス種を選択し、ダブルクリックする。
もしくはPure相から化合物を選択し、ダブルクリックする。
すると Properties 画面が表示されます。
この画面にて、25℃、1気圧を指定し、[CalCulate] ボタンをクリックする。
これだけです。
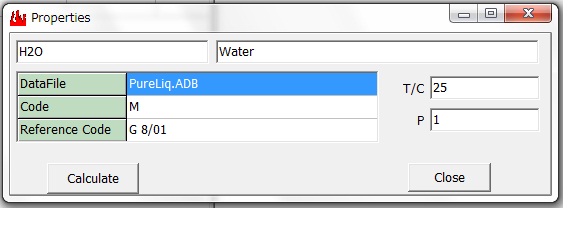
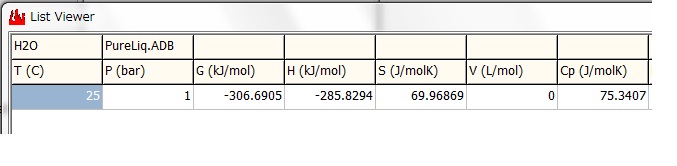
水のProperties画面 と List-Viewer画面 を示します。これより H2O(Liquid)の
標準生成エンタルピー (H) と標準生成エントロピー (S)
H = -285.8294 kJ/mol, S = 69.96869 J/(molK)
値が得られます。
 さらに、次の4項目について見てみよう。
(1) ----- H2O
(2) ----- CH3OH (メタノール)
(3) ----- H2NCONH2 (尿素, urea)
(4) ----- CO2 + H2 = CO + H2O の1000℃における反応熱
このように、CaTCalc は主なガス種・化合物のエンタルピーの表を標準装備しています。
(1) ------------------------------------------------ H2O
H2O(Liquid)の標準生成エンタルピー (H) と標準生成エントロピー (S)
H = -285.8294 kJ/mol, S = 69.96869 J/(molK)
と同じ操作により、ガス種の H2O(g) の値を求めると
H = -241.8274 S = 188.8221
を得る。
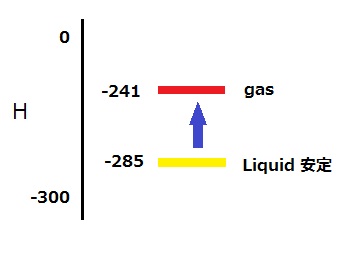
25℃においては液相の H2O が安定であり、
△H = 44 kJ/mol の吸熱によりガス相の H2O に移れる。
さらに、次の4項目について見てみよう。
(1) ----- H2O
(2) ----- CH3OH (メタノール)
(3) ----- H2NCONH2 (尿素, urea)
(4) ----- CO2 + H2 = CO + H2O の1000℃における反応熱
このように、CaTCalc は主なガス種・化合物のエンタルピーの表を標準装備しています。
(1) ------------------------------------------------ H2O
H2O(Liquid)の標準生成エンタルピー (H) と標準生成エントロピー (S)
H = -285.8294 kJ/mol, S = 69.96869 J/(molK)
と同じ操作により、ガス種の H2O(g) の値を求めると
H = -241.8274 S = 188.8221
を得る。
25℃においては液相の H2O が安定であり、
△H = 44 kJ/mol の吸熱によりガス相の H2O に移れる。
 (2) ------------------------------------------------ CH3OH (メタノール)
酸素分子の標準生成エンタルピーを基準にしているが、O2(gas) は
ギブス自由エネルギー式より計算しているためゼロ値にはならない。
CH3OH(Liquid) O2(gas) CO2(gas)
25℃ -238.91 +6.5E-05 -393.51 kJ/mol
入力原料 --> 生成物
CH3OH(Liquid) + 3/2*O2(g) --> CO2(g) + 2*H2O(Liquid)
△H = △H (生成物) - △H (入力原料)
= ( -393.51 + 2(-285.83)) - ( -238.91 + 0)
= -726.26 kJ/mol
したがって 25℃では
CH3OH(Liquid) + 3/2*O2(g) = CO2(g) + 2*H2O(Liquid) + 726.26
この反応は 726 kJ/molの放出がある 発熱反応となる。
(3) ------------------------------------------------ H2NCONH2 (尿素, urea)
NH3 (gas) CO(NH2)2 (Solid)
25℃ -45.94203 -332.879 kJ/mol
入力原料 --> 生成物
2*NH3(g) + CO2(g) --> H2NCONH2(s) + H2O(Liquid)
△H = △H (生成物) - △H (入力原料)
= ( -332.88 + (-285.83)) - ( 2(-45.94) + (-393.51))
= -133.32 kJ/mol
(4) ---------------------------------------------- CO2 + H2 = CO + H2O の1000℃における反応熱
25℃だけでなく、1000℃におけるエンタルピー値も簡単に得られます。
CO2(g) H2(g) CO(g) H2O(g)
25℃ -393.510 +6.8E-5 -110.535 -241.827
1000℃ -344.889 +29.074 -79.597 -204.067 kJ/mol
25℃においては
△H = +41.15 kJ/mol であったが、
1000℃では
CO2(g) + H2(g) --> CO(g) + H2O(g)
△H = △H (生成物) - △H (入力原料)
= ( -79.60) + (-204.07)) - ( -344.89 + 29.07)
= +32.15 kJ/mol
を得る。
なお、CaTCalc ソフトウェアにて、計算対象をガス種のCO2(g)とH2(g)の2個のみと設定し
1気圧、1000℃の平衡計算を行った結果を下に示します。
(2) ------------------------------------------------ CH3OH (メタノール)
酸素分子の標準生成エンタルピーを基準にしているが、O2(gas) は
ギブス自由エネルギー式より計算しているためゼロ値にはならない。
CH3OH(Liquid) O2(gas) CO2(gas)
25℃ -238.91 +6.5E-05 -393.51 kJ/mol
入力原料 --> 生成物
CH3OH(Liquid) + 3/2*O2(g) --> CO2(g) + 2*H2O(Liquid)
△H = △H (生成物) - △H (入力原料)
= ( -393.51 + 2(-285.83)) - ( -238.91 + 0)
= -726.26 kJ/mol
したがって 25℃では
CH3OH(Liquid) + 3/2*O2(g) = CO2(g) + 2*H2O(Liquid) + 726.26
この反応は 726 kJ/molの放出がある 発熱反応となる。
(3) ------------------------------------------------ H2NCONH2 (尿素, urea)
NH3 (gas) CO(NH2)2 (Solid)
25℃ -45.94203 -332.879 kJ/mol
入力原料 --> 生成物
2*NH3(g) + CO2(g) --> H2NCONH2(s) + H2O(Liquid)
△H = △H (生成物) - △H (入力原料)
= ( -332.88 + (-285.83)) - ( 2(-45.94) + (-393.51))
= -133.32 kJ/mol
(4) ---------------------------------------------- CO2 + H2 = CO + H2O の1000℃における反応熱
25℃だけでなく、1000℃におけるエンタルピー値も簡単に得られます。
CO2(g) H2(g) CO(g) H2O(g)
25℃ -393.510 +6.8E-5 -110.535 -241.827
1000℃ -344.889 +29.074 -79.597 -204.067 kJ/mol
25℃においては
△H = +41.15 kJ/mol であったが、
1000℃では
CO2(g) + H2(g) --> CO(g) + H2O(g)
△H = △H (生成物) - △H (入力原料)
= ( -79.60) + (-204.07)) - ( -344.89 + 29.07)
= +32.15 kJ/mol
を得る。
なお、CaTCalc ソフトウェアにて、計算対象をガス種のCO2(g)とH2(g)の2個のみと設定し
1気圧、1000℃の平衡計算を行った結果を下に示します。
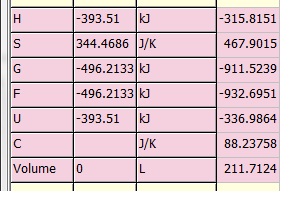 これは ( CO2(g) + H2(g) ) at 25℃ --> ( CO2(g) + H2(g) ) at 1000℃
の計算であり、
1行目左側のH値は、入力原料の25℃における値を示し、-393.510 + 0 = -393.510
1行目右側のH値は、生成物の1000℃における値を示し、-344.889 + 29.074 = -315.815
を意味しています。
戻る
これは ( CO2(g) + H2(g) ) at 25℃ --> ( CO2(g) + H2(g) ) at 1000℃
の計算であり、
1行目左側のH値は、入力原料の25℃における値を示し、-393.510 + 0 = -393.510
1行目右側のH値は、生成物の1000℃における値を示し、-344.889 + 29.074 = -315.815
を意味しています。
戻る
Copyright(C) 2011 Materials Design Technology Co., Ltd. All Rights Reserved.

 さらに、次の4項目について見てみよう。
(1) ----- H2O
(2) ----- CH3OH (メタノール)
(3) ----- H2NCONH2 (尿素, urea)
(4) ----- CO2 + H2 = CO + H2O の1000℃における反応熱
このように、CaTCalc は主なガス種・化合物のエンタルピーの表を標準装備しています。
(1) ------------------------------------------------ H2O
H2O(Liquid)の標準生成エンタルピー (H) と標準生成エントロピー (S)
H = -285.8294 kJ/mol, S = 69.96869 J/(molK)
と同じ操作により、ガス種の H2O(g) の値を求めると
H = -241.8274 S = 188.8221
を得る。
25℃においては液相の H2O が安定であり、
△H = 44 kJ/mol の吸熱によりガス相の H2O に移れる。
さらに、次の4項目について見てみよう。
(1) ----- H2O
(2) ----- CH3OH (メタノール)
(3) ----- H2NCONH2 (尿素, urea)
(4) ----- CO2 + H2 = CO + H2O の1000℃における反応熱
このように、CaTCalc は主なガス種・化合物のエンタルピーの表を標準装備しています。
(1) ------------------------------------------------ H2O
H2O(Liquid)の標準生成エンタルピー (H) と標準生成エントロピー (S)
H = -285.8294 kJ/mol, S = 69.96869 J/(molK)
と同じ操作により、ガス種の H2O(g) の値を求めると
H = -241.8274 S = 188.8221
を得る。
25℃においては液相の H2O が安定であり、
△H = 44 kJ/mol の吸熱によりガス相の H2O に移れる。
 (2) ------------------------------------------------ CH3OH (メタノール)
酸素分子の標準生成エンタルピーを基準にしているが、O2(gas) は
ギブス自由エネルギー式より計算しているためゼロ値にはならない。
CH3OH(Liquid) O2(gas) CO2(gas)
25℃ -238.91 +6.5E-05 -393.51 kJ/mol
入力原料 --> 生成物
CH3OH(Liquid) + 3/2*O2(g) --> CO2(g) + 2*H2O(Liquid)
△H = △H (生成物) - △H (入力原料)
= ( -393.51 + 2(-285.83)) - ( -238.91 + 0)
= -726.26 kJ/mol
したがって 25℃では
CH3OH(Liquid) + 3/2*O2(g) = CO2(g) + 2*H2O(Liquid) + 726.26
この反応は 726 kJ/molの放出がある 発熱反応となる。
(3) ------------------------------------------------ H2NCONH2 (尿素, urea)
NH3 (gas) CO(NH2)2 (Solid)
25℃ -45.94203 -332.879 kJ/mol
入力原料 --> 生成物
2*NH3(g) + CO2(g) --> H2NCONH2(s) + H2O(Liquid)
△H = △H (生成物) - △H (入力原料)
= ( -332.88 + (-285.83)) - ( 2(-45.94) + (-393.51))
= -133.32 kJ/mol
(4) ---------------------------------------------- CO2 + H2 = CO + H2O の1000℃における反応熱
25℃だけでなく、1000℃におけるエンタルピー値も簡単に得られます。
CO2(g) H2(g) CO(g) H2O(g)
25℃ -393.510 +6.8E-5 -110.535 -241.827
1000℃ -344.889 +29.074 -79.597 -204.067 kJ/mol
25℃においては
△H = +41.15 kJ/mol であったが、
1000℃では
CO2(g) + H2(g) --> CO(g) + H2O(g)
△H = △H (生成物) - △H (入力原料)
= ( -79.60) + (-204.07)) - ( -344.89 + 29.07)
= +32.15 kJ/mol
を得る。
なお、CaTCalc ソフトウェアにて、計算対象をガス種のCO2(g)とH2(g)の2個のみと設定し
1気圧、1000℃の平衡計算を行った結果を下に示します。
(2) ------------------------------------------------ CH3OH (メタノール)
酸素分子の標準生成エンタルピーを基準にしているが、O2(gas) は
ギブス自由エネルギー式より計算しているためゼロ値にはならない。
CH3OH(Liquid) O2(gas) CO2(gas)
25℃ -238.91 +6.5E-05 -393.51 kJ/mol
入力原料 --> 生成物
CH3OH(Liquid) + 3/2*O2(g) --> CO2(g) + 2*H2O(Liquid)
△H = △H (生成物) - △H (入力原料)
= ( -393.51 + 2(-285.83)) - ( -238.91 + 0)
= -726.26 kJ/mol
したがって 25℃では
CH3OH(Liquid) + 3/2*O2(g) = CO2(g) + 2*H2O(Liquid) + 726.26
この反応は 726 kJ/molの放出がある 発熱反応となる。
(3) ------------------------------------------------ H2NCONH2 (尿素, urea)
NH3 (gas) CO(NH2)2 (Solid)
25℃ -45.94203 -332.879 kJ/mol
入力原料 --> 生成物
2*NH3(g) + CO2(g) --> H2NCONH2(s) + H2O(Liquid)
△H = △H (生成物) - △H (入力原料)
= ( -332.88 + (-285.83)) - ( 2(-45.94) + (-393.51))
= -133.32 kJ/mol
(4) ---------------------------------------------- CO2 + H2 = CO + H2O の1000℃における反応熱
25℃だけでなく、1000℃におけるエンタルピー値も簡単に得られます。
CO2(g) H2(g) CO(g) H2O(g)
25℃ -393.510 +6.8E-5 -110.535 -241.827
1000℃ -344.889 +29.074 -79.597 -204.067 kJ/mol
25℃においては
△H = +41.15 kJ/mol であったが、
1000℃では
CO2(g) + H2(g) --> CO(g) + H2O(g)
△H = △H (生成物) - △H (入力原料)
= ( -79.60) + (-204.07)) - ( -344.89 + 29.07)
= +32.15 kJ/mol
を得る。
なお、CaTCalc ソフトウェアにて、計算対象をガス種のCO2(g)とH2(g)の2個のみと設定し
1気圧、1000℃の平衡計算を行った結果を下に示します。
 これは ( CO2(g) + H2(g) ) at 25℃ --> ( CO2(g) + H2(g) ) at 1000℃
の計算であり、
1行目左側のH値は、入力原料の25℃における値を示し、-393.510 + 0 = -393.510
1行目右側のH値は、生成物の1000℃における値を示し、-344.889 + 29.074 = -315.815
を意味しています。
戻る
これは ( CO2(g) + H2(g) ) at 25℃ --> ( CO2(g) + H2(g) ) at 1000℃
の計算であり、
1行目左側のH値は、入力原料の25℃における値を示し、-393.510 + 0 = -393.510
1行目右側のH値は、生成物の1000℃における値を示し、-344.889 + 29.074 = -315.815
を意味しています。
戻る